bwin必赢“药用植物资源与分子生物学实验室”在国际刊物International Journal of Biological Macromolecules(IF4.784,JCR一区)在线发表文章“Structural and functional relationship of Cassia obtusifolia trypsin inhibitor to understand its digestive resistance against Pieris rapae”。 该文在撰写过程中得到了清华大学隋森芳教授(西南交通大学双聘院士)与西南交通大学黄新河副教授的指点,特此表示感谢。


蛋白酶抑制剂(Protease inhibitor,PI)是广泛存在于动物、植物及微生物中的肽类与活性小分子,能够与靶蛋白酶形成复合物,特异性抑制靶蛋白酶的活性。PI广泛参与生物体生长、发育与胁迫响应的生物学过程,其在基础生物学、农业、药物设计及临床等领域已显示出令人振奋的前景与潜在应用价值。据《中国科学》杂志报道,2019年底-2020年初爆发的新型冠状病毒肺炎疫情中,武汉新型冠状病毒2019-nCoV与SARS病毒的基因组有超过80%的相似度,其中参与病毒繁殖与传播等过程的重要蛋白酶的氨基酸序列相似度超过95%,提示围绕这些重要蛋白酶设计相关抑制剂有望靶向抑制病毒的繁殖与传播过程。
课题组采用结构生物学等方法获得决明胰蛋白酶抑制剂的三维晶体结构(分辨率1.9 Å)。其结构由3个类似DOMAIN形成β-三叶草形状,包括疏水的底部桶与亲水的顶部盖,抑制中心位于相邻β-sheet间的loop上(Fig 1)。文章首次发现Phe139残基不仅通过疏水作用稳定β-三叶草整体结构,而且也与抑制环的空间构象紧密相关,进一步的定点突变与荧光光谱证实Phe139残基突变后,将导致抑制活性下降与三维结构的改变。同时,我们还发现位于抑制环中的Arg86残基为决明胰蛋白酶抑制剂发挥抑制作用的关键残基,其能够与胰蛋白酶底物口袋中的Asp189残基形成氢键或离子键,Arg86突变为Ala后,抑制活性损失超过95%,表明抑制环的氨基酸组成对于抑制活性至关重要。以上结果表明,抑制剂的整体结构、抑制环的空间构象与抑制环的氨基酸组成是决定决明胰蛋白酶抑制剂抑制活性的3个重要因素,这为抑制剂的靶向设计提供了思路。更为重要的是,我们发现决明胰蛋白酶抑制剂对鳞翅目害虫Pieris rapae表现出较强抗性,结合同源建模与转录组学分析,我们推测Trypsin-1可能是决明胰蛋白酶抑制剂的作用靶点,该结果对认识其作用机制奠定了重要的理论基础(Fig 2)。
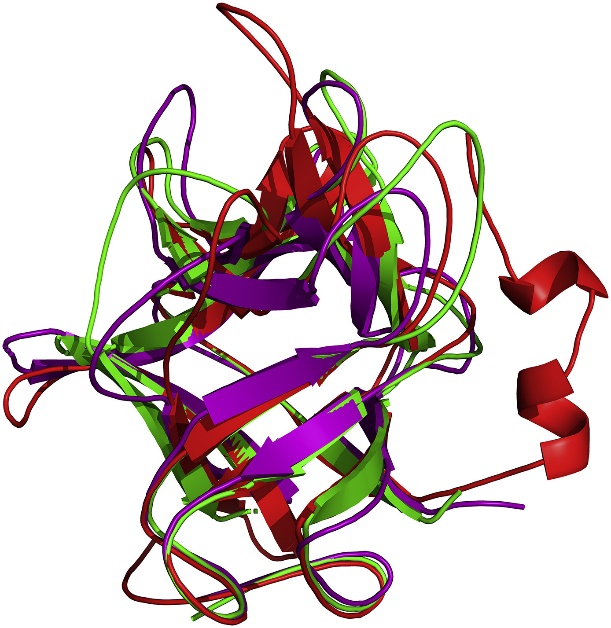
Fig. 1. Structural superposition of all structures of inhibitor COTI (red), STI (green) and TKI (purple).
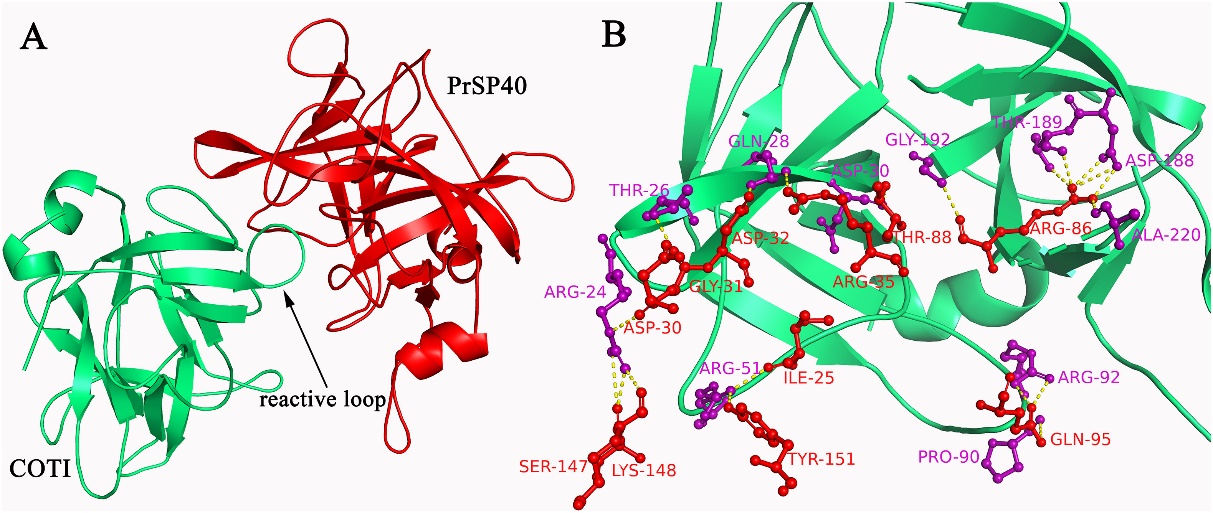
Fig. 2. The complex of COTI with PrSP40. (A) Ribbon diagram representing the docking structure of COTI with PrSP40. (B) The interactions of COTI with PrSP40 in the interface region. Amino acid residues in COTI and bovine trypsin were labeled as red and blue colors, respectively. The hydrogen bonds between COTI and bovine trypsin were shown as yellow dashed lines.
论文第一作者为周嘉裕,通讯作者为廖海,余雅梅(四川大学)。该项工作得到了国家自然科学基金(31500276),四川省科技项目(2017JY0222,2018SZ0061与2019YFH0123)的资助。
